ICH E5(R1) 接受国外临床试验数据的种族因素
1. 前言
本指南的目的,是推荐一个用于评估种族因素对药物疗效的影响的框架,即某一特定剂量和给药方案对该药的安全性和有效性的影响,从而帮助药品在国际协调会议(ICH)地区注册。本指南为监管和研发策略提供指导,尽可能减少重复临床研究,尽快为患者提供药物使其获益的同时,又对种族因素的影响进行了充分的评估。本指南将与其他ICH 指南一起实施。根据本文件的目的,种族因素被定义为人群中与遗传和生理因素(内因)、以及文化和环境(外因)特征有关的因素。(附录A).
1.1 目的
- 描述国外临床试验数据的特征,以便将其外推到不同人群,支持药品在新地区注册。
- 尽量减少重复的临床研究,及促进新地区接受国外临床试验数据的监管策略。
- 应用桥接研究,必要时允许将国外临床试验数据外推到新地区。
- 能够表征种族因素对安全性、有效性、剂量和给药方案的影响的研发策略。
1.2 背景
申请注册时,所有地区都接受符合法规标准及该地区申请注册要求的国外临床试验数据。
但是种族差异可能影响药物的安全性、有效性、剂量和给药方案,使得新地区对国外临床试验数据的接受程度受到限制。这也是以往在新地区提交注册申请时,监管机构要求其在新地区完全或大部分重复国外临床研究和验证的原因之一。虽然不同人群之间的种族差异可能导致药物的安全性、疗效、剂量或给药方案的差异,但很多药物在不同地区的人群之间具有相似的特征和作用。要求对每一个药物进行大量重复的临床研究,可能会延迟新疗法的应用和浪费不必要的药物研发资源。
1.3 范围
本指南的前提是,没有必要在新地区重复进行药物的全部临床研发过程,建议全部或部分的接受国外临床研究数据,以支持药物在新地区的注册审批。首先需要申明的是,本指南并不是为了在新地区申请注册药品而修改对临床数据的要求,而是旨在国外临床研究数据可能符合新地区的注册要求时,推荐接受国外临床资料。临床数据集的所有数据资料,包括国外数据,必须符合新地区的研究设计和实施标准,遵循新地区的监管要求。新地区可要求申办者在该地区进行附加研究以完善临床数据集。
若现有临床数据集符合新地区的管理要求,这些国外数据是否能被接受,还取决于该数据能否外推到新地区的人群。当监管机构或申办者认为种族因素可能改变药物在新地区人群中的安全性或有效性时,申办者可能需要在新地区获得一定的临床数据,以便将两个地区之间的临床数据外推或桥接起来。
如果申办者需要获得额外的临床数据,以满足新地区的监管要求,则可以将这些临床试验设计成桥接研究(bridging study)。
因此,申办者和新地区的监管机构对于该项注册申请需要评估的内容包括:
(1)完全符合新地区监管要求;
(2)将国外临床研究中的部分(大部分或全部)数据应用到新地区的可能性。(附录B)
2. 评估包括国外临床数据的临床数据集,以满足新地区的监管要求
新地区的监管机构将评估包括国外临床数据的临床数据集,以确定该数据的性质和质量是否符合该地区所有的监管标准,而不考虑该数据全部来源于国外、部分来源于国外、还是部分来源于即将申请注册的地区。可通过审批的完整临床数据集的定义为,符合所有地区监管要求的临床数据集。完整临床数据集中的国外临床数据是否被接受,取决于它能否外推到新地区人群中。
在考虑外推之前,递交给新地区的包括国外临床数据的完整临床数据集应当包括以下内容:
- 国外人群的药动学、药效学、量-效关系、安全性和有效性特点;
- 确立药物量-效关系、有效性和安全性的临床研究。这些研究包括:
- 根据新地区监管标准进行设计和实施,例如对照药的选择,且遵照临床试验管理规范(GCP)实施;
- 研究充分,且具有良好的对照;
- 采用合适的治疗终点进行评价;
- 疾病评估时所采用的治疗和诊断的定义能够被新地区所接受。
- 描述新地区人群的药动学特征,以及(在可能的情况下)药效学特征和以药效学为终点指标的量-效关系特征。应在能够代表新地区人群的国外人群,或在新地区人群中开展研究。
针对临床试验的设计、实施、分析和报告各方面的一系列ICH 指南,将有助于实现完整临床数据集的概念。这些指南包括 GCP(E6)、量-效关系评估(E4)、充分的安全性数据(E1 和E2)、老年用药研究(E7)、研究结果的报告(E3)、一般临床试验的总体考虑(E8)及统计学考虑(E9)。临床试验对照组的选择指导原则(E10)尚待完善。
2.1 根据新地区监管要求的附加临床研究
当国外临床资料不符合新地区的监管要求时,新地区的监管机构可能会要求增加临床试验,例如:
- 增加在特殊人群中的临床试验:如肾功能不全及肝功能不全的病人等;
- 按照新地区批准的剂量和给药方法,以不同的对照药进行临床试验;
- 药物相互作用研究。
3. 评估国外临床试验数据从而外推到新地区
3.1 药物的种族敏感性特征
评估一个药物对种族因素的敏感性,必须了解它的药动学和药效学特征以及应用这些特征解释临床安全性和有效性。附录 C 中描述了一种合理的评估方法。药物的某些特性(化学分类,代谢途径,药理学分类)决定了该药物更容易或不易受到种族因素的影响(附录D)。药物对种族因素不敏感,即不太可能在不同人群中表现出差异,通常会使国外临床数据更容易由一个地区外推到另一个地区中,并且需要较少的桥接数据。
通过比较不同地区的药物效应,药物对种族因素是否敏感将变得更容易理解和评价。然而,显而易见的是,若药物的代谢酶存在基因多态性、量-效曲线陡峭,将更可能存在种族差异。相反,药物缺乏代谢或主动排泄、治疗窗宽、以及量-效曲线平缓,则不易出现种族差异。同类药物在新地区应用的临床经验,也有助于评估药物对种族因素的敏感性。如果在新地区中,相同药理学特征的同类药物,采用与原地区相同的剂量和给药方案进行研究并获批,可能较容易得出药物的药效学和临床行为在国外和新地区也是类似的结论。
3.2 桥接数据集
3.2.1 桥接数据集和桥接研究的定义
一个桥接数据集包括:(1)从完整临床数据集中选出与新地区人群相关的信息,包括药动学数据,药效学和量-效关系数据;(2)有可能需要将国外的有效性和/或安全性数据外推到新地区的桥接研究数据。
桥接研究的定义是,在新地区进行的一项研究,旨在提供新地区的有效性、安全性、剂量和给药方案的药效学或临床数据,从而能够将国外临床数据外推到新地区人群。有效性的桥接研究可以为新地区人群提供额外的药动学信息。当不需要桥接研究提供临床疗效数据时,在新地区进行的药动学研究即可看做是桥接研究。
3.2.2 桥接研究的类型与范围
本指南建议,当新地区监管机构收到符合其监管要求的临床数据集时,应要求递交完整临床数据集中可外推到新地区的必须附加的数据资料集。药物是否存在种族敏感性,决定了这些数据的数量。多数情况下,在新地区进行一个单独的临床试验就能提供这些数据,以满足由原地区外推到新地区的需要,不必再进一步开展重复研究。值得注意的是,虽然有时一个桥接研究就足够用来桥接药物的有效性数据,但实际上申办者可能需要开展更多的研究以获得必要的资料。例如,如果需要采用临床终点,固定剂量的量-效关系研究作为桥接研究,可以用短期的临床药理学终点研究来为较大规模(临床终点)的研究选择给药剂量。
当监管机构要求,或申办者决定实施一个桥接研究,在可能的情况下,鼓励他们通过讨论决定实施何种类型的桥接研究。相对的种族敏感性有助于决定是否进行桥接研究以及进行何种类型的桥接研究。对于没有使用国外数据进行药品注册的经验的地区,即使该药物无种族敏感性,监管机构仍应要求一个桥接研究。当地区间互相接受数据的经验增加,对桥接研究的必要性会有更好的认识。希望随着经验丰富,减少对桥接研究数据的需求。
基于桥接研究数据进行外推的总体指南如下:
- 如果桥接研究证实在新地区的量-效关系、安全性和有效性与国外相似,则该研究即可说明其能够桥接国外数据。
- 如果一个实施恰当的桥接研究表明,在新地区不同剂量下的安全性和有效性结果与原地区没有较大差异,通常可将国外数据外推到新 地区,也可通过适当的剂量调整(采用药动学和/或药效学数据)将国外数据外推到新地区。
- 如果桥接研究的规模不能充分描述新地区的不良反应情况,从而将国外数据外推至新地区,则必须增加安全性数据(3.2.4 部分)。
- 如果桥接研究未能验证药物的安全性和有效性,则需要额外的临床数据(如确证性临床研究)。
3.2.3 有效性的桥接研究
通常对种族因素不敏感的药物,所需桥接研究(如果需要)的类型取决于此类药物的用药经验和外在的种族因素(包括临床试验的设计与实施)对药物安全性、有效性以及量-效关系可能存在的影响。对于种族因素敏感的药物,如果两个地区人群有差异,通常需要桥接研究。以下示例说明了不同情况下应考虑采用的桥接研究类型:
无桥接研究
如果药物对种族不敏感,并且外在因素如医疗措施和临床试验的实施在两地区大致相同。
如果药物对种族敏感,但两地区种族相似,并且药理机制类似的药物有足够的临床经验,可保证该类药物在两地区病人中的安全性、有效性、剂量和给药方案方面相似。这可能是对于给药方式类似的同类药物的情况,同类药物在两个地区应用情况类似,但不一定相同。
临床药理学终点的桥接研究
如果两地区之间有种族差异,而且药物对种族敏感,但外在因素大致相同(如医疗实践,临床试验设计和实施),且该类药物在新地区有临床经验,则在新地区采用反映药物活性的药理学终点(经过验证的替代终点)进行对照的药效学研究,可保证在原地区建立的有效性、安全性、剂量和给药方案适用于新地区。同时药动学(即血药浓度)监测可使这些研究更有说服力。
对照临床试验
在以下情况,通常需要在新地区进行对照试验,常为随机、固定剂量的量-效关系研究:
1. 对剂量的选择有疑问时;
2. 缺乏接受国外对照临床试验数据的经验;
3. 医学实践不同如合并用药不同,临床试验的设计和/或实施不同;
4. 新地区对此类药物不熟悉。
根据这些具体情况,可以重复国外临床研究,或采用标准的临床终点进行短期研究,或采用经过验证的替代终点,如血压或胆固醇(国外三期临床试验中可能已采用更长时间的研究和其他终点)。
如果药效学数据提示地区间疗效有差异,通常有必要在新地区进行一项临床终点的对照试验。药动学的差异并不一定需要进行这样的对照试验,因为在某些情况下,只需调整剂量而不需要进行新的临床试验,但代谢方式存在本质区别时,通常提示需要进行对照临床试验。
当医学实践在合并用药方面存在显著差异,或者辅助治疗可能改变药物的安全性或有效性时,那么桥接研究应为一项对照临床试验。
3.2.4 安全性的桥接研究
即使国外临床数据已表明药物在国外应用的有效性和安全性,有时在新地区仍可能出现需要关注的安全性问题,这包括对新地区常见不良事件发生率的精确估计,以及严重事件的发现(1%的发生率通常需要评估约300 例患者)。依据安全性问题的性质,在下述情况下需要获得安全性资料:
- 评估有效性的桥接研究(例如量-效关系研究),因能估计常见的不良反应发生率,也可识别新地区更常见的严重不良事件,从而更具 有说服力。在新地区对这样的试验进行密切监测,将有助于识别这类严重事件,避免药物暴露到新地区的大量患者当中。或者,可以在桥接研究之前进行一项小规模的安全性研究,以确保严重不良反应不会高频率发生。
- 如果不需要有效性桥接研究,或有效性桥接研究规模过小,或研究时间过短不足以提供充分的安全性信息,则可能需要进行单独的安全性研究,可见于以下情况:
- 国外临床数据中有严重不良反应的病例;
- 新地区与国外报道的不良反应存在差异的;
- 新地区只有有限的来源于药效桥接研究的安全性数据,不足以外推到安全性的重要方面,例如,常见不良反应发生率或更严重的不良反应。
4. 全球研发策略
Definition在研发早期,药动学、药效学和量-效关系的确定,可能有助于确定进行何种桥接研究及其必要性。全球研发的候选药物可能具有种族敏感或种族不敏感的特征(附录D)。理想情况下,这些研究应在药物研发的早期阶段,例如临床药理学和药效探索研究期间进行。某些情况下,在完成临床资料收集之前,与监管机构讨论桥接研究的设计非常有益。但是,对完整临床数据集中的数据进行分析,将确定进行何种桥接研究及其必要性。为了全球研发,研究应包含即将注册地区的代表性人群,并按照ICH of not only pharmacokinetics but also pharmacodynamics and dose response early in the development program may facilitate the determination of the need for, and nature of, any requisite bridging data. Any candidate medicine for global development should be characterized as ethnically sensitive or insensitive (Appendix D). Ideally, this characterization should be conducted during the early clinical phases of drug development, i.e., human pharmacology and therapeutic exploratory studies. In some cases, it may be useful to discuss bridging study designs with regulatory agencies prior to completion of the clinical data package. However, analysis of the data within the Complete Clinical Data Package will determine the need for, and type of bridging study. For global development, studies should include populations representative of the regions where the medicine is to be registered and should be conducted according to ICH guidelines.
A sponsor may wish to leave the assessment of pharmacokinetics, pharmacodynamics, dosage and dose regimens in populations relevant to the new region until later in the drug development program. Pharmacokinetic assessment could be accomplished by formal pharmacokinetic studies or by applying population pharmacokinetic methods to clinical trials conducted either in a population relevant to the new region, or in the new region.规范实施。申办者可能希望在药物研发的后期评估新地区相关人群的药动学、药效学、剂量和给药方案。药动学评估可采用正式的药动学研究,或在新地区采用群体药动学方法,或在新地区的相关人群中进行临床试验。
5. SUMMARY总结
This guidance describes how a sponsor developing a medicine for a new region can deal with the possibility that ethnic factors could influence the effects (safety and efficacy) of medicines and the risk/benefit assessment in different populations. Results from the foreign clinical trials could comprise most, or in some cases, all of the clinical data package for approval in the new region, so long as they are carried out according to the requirements of the new region. Acceptance in the new region of such foreign clinical data may be achieved by generating “bridging” data in order to extrapolate the safety and efficacy data from the population in the foreign region(s) to the population in the new region.本指南阐述申办者在新地区进行药品注册时,如何处理不同人群中,种族因素可能对药物作用(有效性和安全性)及风险/效益评估的问题。只要国外临床试验数据是按新地区的监管要求获得的,那么其结果可构成大部分,有时甚至是全部的临床药物临床数据集,从而用于药物在新地区的注册。在新地区中接受这样的国外临床数据,可通过桥接研究来实现,以便将国外人群中获得的安全性和有效性数据外推到新地区。
GLOSSARY词汇表
|
|
|
|
|
|
| ICH |
|
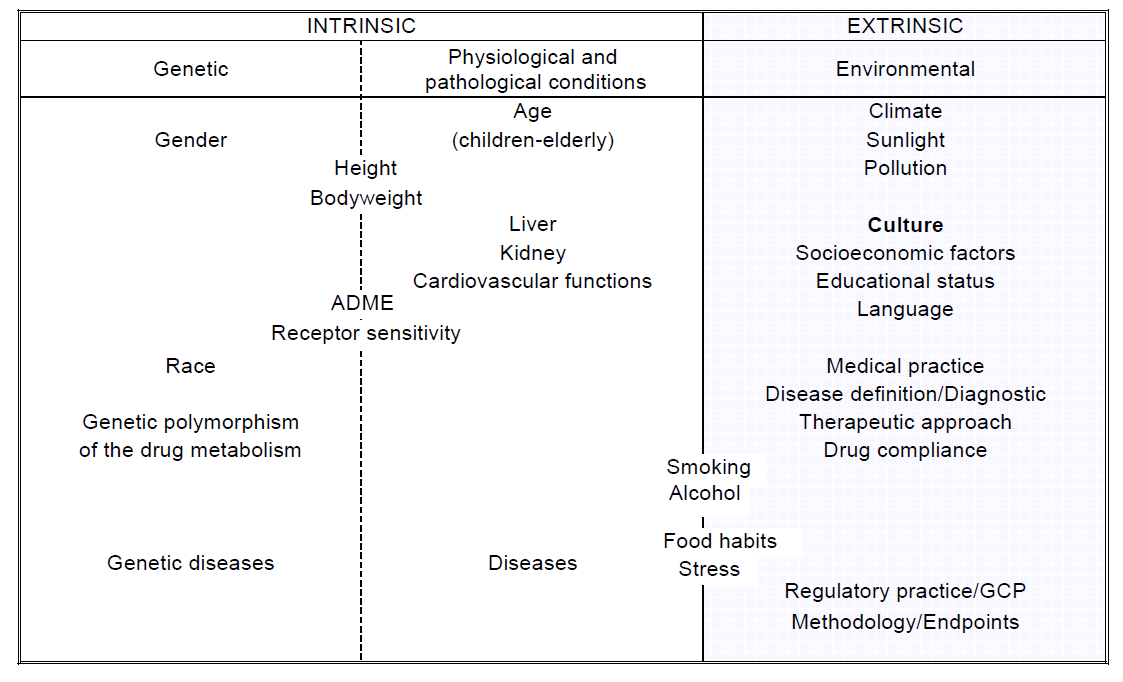
APPENDIX A附录A
Classification of intrinsic and extrinsic ethnic factors内在和外在种族因素的分类
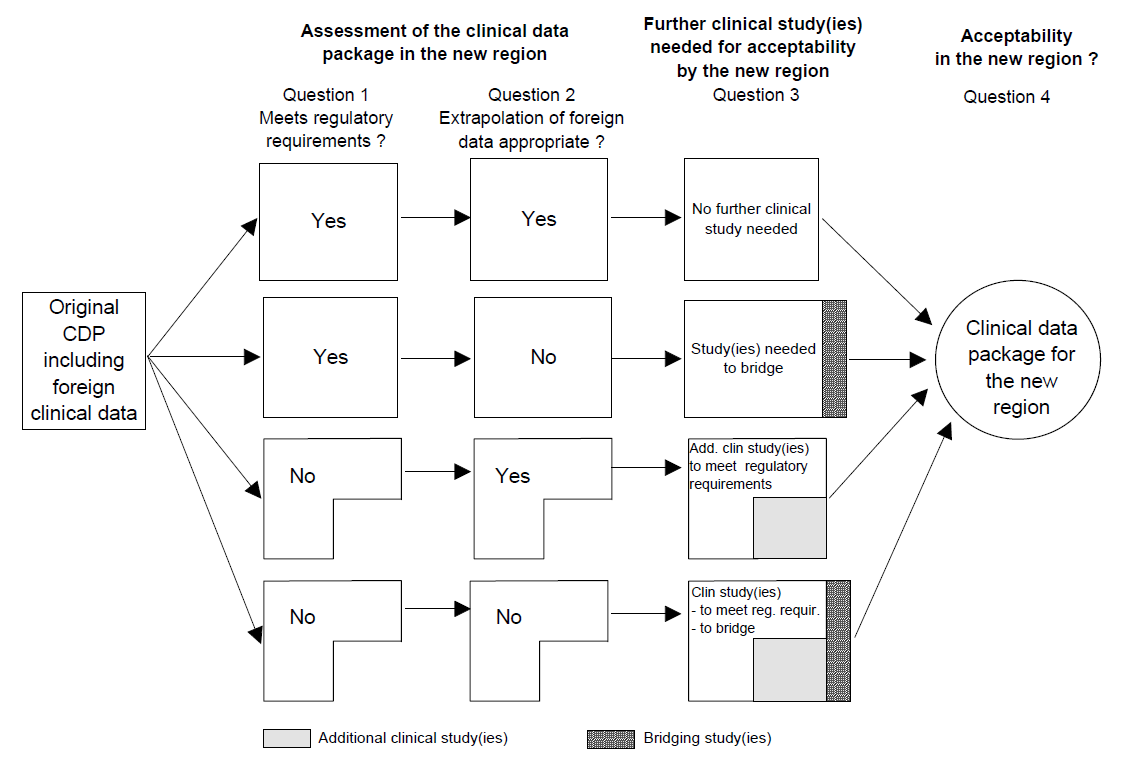
APPENDIX B附录B
Assessment of the clinical data package (CDP) for acceptability临床数据集(CDP)可接受性的评估
APPENDIX C附录C
Pharmacokinetic, Pharmacodynamic, and Dose Response Considerations对药动学、药效学和量-效关系的考虑
Evaluation评估ICH of区域最相关的三个主要种族群体(亚洲人、黑种人和白种人)的药动学、药效学以及它们的可比性,对于ICH the pharmacokinetics and pharmacodynamics, and their comparability, in the three major racial groups most relevant to the ICH regions (Asian, Black, and Caucasian) is critical to the registration of medicines in the ICH regions. Basic pharmacokinetic evaluation should characterize absorption, distribution, metabolism, excretion (ADME), and where appropriate, food-drug and drug-drug interactions.地区的药品注册至关重要。基本的药动学评估需阐明药物的吸收、分布、代谢、排泄(ADME)特征,以及合适的药物-食物、药物-药物相互作用。
Adequate pharmacokinetic comparison between populations of the two regions allows rational consideration of what kinds of further pharmacodynamic and clinical studies (bridging studies) are needed in the new region. In contrast to the pharmacokinetics of a medication, where differences between populations may be attributed primarily to intrinsic ethnic factors and are readily identified, the pharmacodynamic response (clinical effectiveness, safety, and dose-response) may be influenced by both intrinsic and extrinsic ethnic factors and this may be difficult to identify except by conducting clinical studies in the new region.两个地区之间充分的药动学比较,将有助于在新地区合理选择进一步的药动学研究和临床研究(桥接研究)的种类。人种间药动学的差异可能与内在的种族因素有关,且这种差异易于鉴别。与之不同的是,药效学反应(临床疗效、安全性和量-效关系)可能受到内在、外在种族因素的影响,且很难鉴别,除非在新地区进行临床试验。
The ICH-E4 document describes various approaches to dose-response evaluation. In general, dose-response (or concentration response) should be evaluated for both pharmacologic effect (where one is considered pertinent) and clinical endpoints in the foreign region. The pharmacologic effect, including dose-response, may also be evaluated in the foreign region in a population representative of the new region. Depending on the situation, data on clinical efficacy and dose-response in the new region may or may not be needed, e.g., if the drug class is familiar and the pharmacologic effect is closely linked to clinical effectiveness and dose-response, these foreign pharmacodynamic data may be a sufficient basis for approval and clinical endpoint and dose-response data may not be needed in the new region. The pharmacodynamic evaluation, and possible clinical evaluation (including dose-response) is important because of the possibility that the response curve may be shifted in a new population. Examples of this are well-documented, e.g., the decreased response in blood pressure of blacks to angiotensin-converting enzyme inhibitors.指南阐述了多种剂量-效应关系评估的方法。通常,国外研究应通过药理效应(被认为是相关的)和临床终点来评估剂量-效应(或浓度-效应)关系。也可以在国外能代表新地区的研究中评估药理效应,包括量-效关系。根据不同情况,新地区不一定需要临床疗效和量-效关系相关的数据。例如,当新地区对某类药物较熟悉,且药理效应与临床疗效、量-效关系密切相关时,这些国外药效学数据就足以用于申请注册,那么新地区可能不需要临床终点研究和量-效关系研究的数据。由于新地区的人群中量-效关系曲线可能会迁移,药效学评价和可能的临床终点评价(包括量-效关系)就显得非常重要。这方面已有确切的案例报道,例如黑人的血压对血管紧张素转换酶抑制剂的反应低下。
APPENDIX D附录D
A Medicine’s Sensitivity to Ethnic Factors对种族因素敏感的药物
Characterization of a medicine according to the potential impact of ethnic factors upon its pharmacokinetics, pharmacodynamics and therapeutic effects may be useful in determining what sort of bridging study is needed in the new region. The impact of ethnic factors upon a medicine’s effect will vary depending upon the drug’s pharmacologic class and indication and the age and gender of the patient. No one property of the medicine is predictive of the compound’s relative sensitivity to ethnic factors. The type of bridging study needed is ultimately a matter of judgement but assessment of sensitivity to ethnic factors may help in that judgement.根据种族因素对药物的药动学、药效学以及治疗作用的潜在影响而得出的药物特征,有助于决定在新地区选择何种桥接研究。种族因素对药物的影响取决于该药的药理学分类、适应证和患者的年龄与性别。药物的任何特性都不能预测其对种族因素的相对敏感性。桥接研究种类的选择是一个最终决策,而对药物种族敏感性的分析有助于作出决策。
The following properties of a compound make it less likely to be sensitive to ethnic factors:以下所述的特性,提示药物可能对种族因素不敏感:
Linear pharmacokinetics (pK)线性药动学(PK);A flat pharmacodynamic (PD) (effect-concentration) curve for both efficacy and safety in the range of the recommended dosage and dose regimen (this may mean that the medicine is well-tolerated)在推荐剂量和给药方案范围内,有效性和安全性均呈平缓的药效学(PD)曲线(浓度-效应)(这意味着药物有较好的耐受性);A wide therapeutic dose range* (again, possibly an indicator of good tolerability)治疗窗宽(可能也是一个耐受性较好的指标);Minimal metabolism or metabolism distributed among multiple pathways较少代谢,或通过多种途径代谢;High bioavailability, thus less susceptibility to dietary absorption effects生物利用度高,不受饮食吸收作用的影响;Low potential for protein binding蛋白结合率低;Little potential for drug-drug, drug-diet and drug-disease interactions药物-药物,药物-食物,药物-疾病的相互作用小;Non-systemic mode of action局部起效;Little potential for inappropriate use被不恰当使用的几率小。
The following properties of a compound make it more likely to be sensitive to ethnic factors:以下所述的特性,提示药物对种族因素敏感:
Non-linear pharmacokinetics非线性药动学;A steep pharmacodynamic curve for both efficacy and safety (a small change in dose results in a large change in effect) in the range of the recommended dosage and dose regimen在推荐剂量和给药方案范围内,有效性和安全性均呈陡峭的药效学曲线(很少的剂量变化引起极大的效应改变);A narrow therapeutic dose range治疗窗窄;Highly metabolized, especially through a single pathway, thereby increasing the potential for drug-drug interaction代谢率高,特别是通过单一途径代谢,增加了药物-药物相互作用的可能性;Metabolism by enzymes known to show genetic polymorphism药物代谢酶具有遗传多态性;Administration as a prodrug, with the potential for ethnically variable enzymatic conversion前体药物,其转化酶具有潜在的种族差异;High inter-subject variation in bioavailability生物利用度的个体间差异大;Low bioavailability, thus more susceptible to dietary absorption effects生物利用度低,易受饮食吸收作用的影响;High likelihood of use in a setting of multiple co-medications在多种药物联合时,使用率较高;High likelihood for inappropriate use , e.g., analgesics and tranquilizers.易被不恰当使用,如镇痛及镇定药。
